- Buitenwiet test ’24 update #3: nog meer nieuwe wietplanten!
- Nieuw avontuur Strain Hunters: op expeditie in Thailand
- Waarom fimmen soms beter is dan toppen
- 13 manieren om je cannabis high te versterken en te verlengen!
- Bio Bertje oogst zijn ’top terps’ …en een beetje toprót…
- Help Lieve Muna, één van mijn wietplanten wordt geel
Zo wordt cannabis getest op cannabinoïden, pesticiden en meer

Net als elk ander medicijn wil je bij een cannabisproduct weten dat je een schoon en veilig product inneemt, vrij van pesticiden en schimmels. Daarnaast is het belangrijk de samenstelling van werkzame stoffen in bijvoorbeeld je zelfgemaakte cannabisolie te weten. Dat bepaalt immers samen met de aanwezige terpenen de medicinale waarde van je wietproduct. Steven Cassini legt uit hoe hij bij zijn researchcentrum cannabis analyseert en test op alle belangrijke punten.
Belang van analyse
Het testen van cannabisproducten op de aanwezigheid van cannabinoïden is nodig om de medicinale waarde te kunnen bepalen. Het gaat daarbij niet alleen om de sterkte maar ook om de samenstelling. Een product met veel CBD en weinig THC heeft namelijk een hele andere uitwerking dan een product met veel THC en weinig CBD.
Wat betreft de cannabinoïde-waarden is Bedrocan dus net zo ‘gestandaardiseerd’ als wanneer je zelf een wietsoort zou klonen door te stekken
Naast THC en CBD zijn er nog meer dan 100 andere cannabinoïden met een medicinale werking. De medicinale werking wordt echter niet alleen bepaald door de verhouding en concentratie aan cannabinoïden, maar ook de verhouding en samenstelling van de terpenen en andere stoffen.
Identificeren en kwantificeren
Tijdens het analyseren willen we graag 2 sets gegevens vaststellen. Namelijk of de stof die we zoeken daadwerkelijk aanwezig is in het monster door deze te identificeren. En ten tweede wat de concentratie van de geidentificeerde stof is door het te kwantificeren. Identificeren is dus het herkennen van de aanwezige stof in een monster en kwantificeren is het bepalen van de aanwezige hoeveelheid van de geidentificeerde stof.
Referentiestandaard
Om een bepaalde stof te identificeren en te kwantificeren moet je het kunnen vergelijken met een referentiestandaard. Een referentiestandaard is een vergelijkingsmonster waarvan de stof is geindentificeerd en de concentratie van de stof is vastgesteld. Bijvoorbeeld 1mg CBD en THC in 1mL Hexaan.
Aangezien we exact weten hoeveel stof er in de referentiestandaard zit, kunnen we zeer nauwkeurig een monster met een onbekende verhouding en samenstelling identificeren en kwantificeren door het te vergelijken met de referentiestandaard waarvan we de exacte samenstelling weten. Een referentie standaard is gecertificeerd en wordt geleverd door een chemie-leverancier. Zie deze brochure voor meer informatie over de beschikbare referentiestandaarden.
Monster klaarmaken
Allereerst moeten we het monstermateriaal homogeniseren door het eventueel te vermalen en te mengen tot een egale massa met gelijke deeltjes. Vervolgens moet van dit mengsel een bepaald gewicht worden afgewogen op een geijkte analytische weegschaal. In dit voorbeeld wegen we voor het gemak 100mg af. Afhankelijk van het monstertype (Raw cannabis, verdunde olie of concentraat) kan dit ook meer of minder zijn.
Voordat er iets geanalyseerd kan worden moeten de monsters/smaples worden klaargemaakt. [Foto: shutterstock/Swapan Photography]
Nu dat we een 100mg monster hebben moeten we dit in een reageerbuisje doen zodat we de cannabinoïden kunnen oplossen in een oplosmiddel. Het oplosmiddel wordt toegevoegd aan het reageerbuisje samen met het monster waarbij de cannabinoïden die zich in het monster bevinden middels UAE (Ultrasonic Assisted Extraction) worden geëxtraheerd. Door de ultrasone shockgolven worden de cannabinoïden effectief en volledig uit het monster getrokken en komen deze terecht in het oplosmiddel.
Centrifugeren
Omdat we nu een reageerbuisje hebben met oplosmiddel waarin ook kleine deeltjes van het monster (plantmateriaal) rondzweven moeten we deze centrifugeren in een speciale lab-centrifuge. Door het centrifugeren op een bepaalde snelheid zullen de zware plantdeeltjes naar de bodem van het reageerbuisje zakken terwijl de cannabinoïden in het oplosmiddel blijven zweven. Als we het centrifugeren zouden overslaan dan kan dit afwijkingen veroorzaken in het testresultaat. De microscopisch kleine deeltjes (of klontjes) kunnen dan bij de volgende stap terecht komen in de micropipet. Deze kleine klontjes kunnen meer of minder cannabinoïden bevatten en daardoor voor afwijkingen zorgen.
Testmethode
Nu dat we een monster hebben klaargemaakt om te testen moeten we bepalen welke testmethode we gaan gebruiken. Er zijn een aantal verschillende testmethoden zoals HPLC (High-performance Liquid Chromatography), GC (Gas Chromatography), HPTLC (High Performance Thin Layer Chromatography), TLC (Thin Layer Chromatography) en MS (Massa Spectrometry).
HPLC en GC zijn de meest accurate methoden om kwantitatief cannabis te testen. MS is een zeer gevoelige methode en is meer geschikt voor kwalitatieve analyses zoals het detecteren van cannabinoïden in bloed of urine. MS is in tegenstelling tot HPLC en GC veel gevoeliger, maar daardoor wel minder accuraat. MS wordt vaak gebruikt bij drugstesten om te controleren of een persoon drugs heeft gebruikt of om te testen of er sporen op een item aanwezig zijn zoals vaak op vliegvelden wordt gedaan door bagage te controleren op sporen. HPTLC en TLC zijn goedkopere testmethoden en minder nauwkeurig dan HPLC of GC. Volgens een studie uitgevoerd door Arno Hazekamp is de HPTLC methode, indien deze juist wordt uitgevoerd, relatief reproduceerbaar en accuraat.
HPLC of GC
Het grootste verschil tussen HPLC en GC is dat bij GC de cannabinoïde-zuren zoals THC-A en CBD-A standaard niet gemeten kunnen worden omdat bij GC het monster wordt verhit waardoor decarboxylatie plaatsvindt. De cannabinoïde-zuren kunnen wel met GC worden gemeten wanneer we een stabilisator toevoegen.

Dit apparaat (TRACE™ Ultra gaschromatograaf) heeft een speciale kolom die speciaal ontwikkeld is om cannabinoïden en terpenen optimaal te scheiden.
Bij LaCassini Research hebben we gekozen voor de GC methode met FID-detector. Dit omdat de overheid deze methode verplicht voor het analyseren van vezelhennep. De inspectie van de Nederlandse Voedsel- en Warenautoriteit (NVWA) voert namelijk steekproefsgewijs veldcontroles uit bij de vezelhennep-boeren.
Zij sturen een monster op naar het RIKILT (Wageningen University & Research) om te controleren op het THC-gehalte in de vezelhennep (mag max. 0,2% bevatten). Daarbij is het RIKILT overheidshalve verplicht om de analyse uit te voeren met GC en niet met HPLC. Dit betekent dat een HPLC analyse voor de overheid geen waarde heeft omdat de methode van analyse niet conform de Europese richtlijnen is uitgevoerd. Dit betekent ook dat de overheid kijkt naar de potentieel aanwezige THC waarbij dus de THC-A (zure, niet-psychoactieve vorm van THC) alszijnde THC wordt gerapporteerd.
Een ander voordeel van GC is dat we CBD kunnen gebruiken als referentiestandaard om de THC te kwantificeren. Dit kan omdat CBD exact dezelfde molaire massa heeft als THC. Een CBD referentiestandaard is veel stabieler dan een THC referentiestandaard en is daarom een betere kandidaat om nauwkeurig THC mee te bepalen.
Op het lab hebben we twee TRACE™ Ultra gaschromatografen staan met een Rxi-35Sil kolom welke speciaal is ontwikkeld voor het optimaal scheiden van de cannabinoïden en terpenen. Bovenop de Gaschromatograaf zit een autosampler (robot) welke zeer nauwkeurig een injectie kan uitvoeren. Dat is meer reproduceerbaar dan een handmatige injectie in de kolom.
Verder met de analyse…
Het monster dat we hebben bereid kunnen we nu injecteren in de capilaire kolom alwaar het monster wordt verbrand en omgezet in gasvorm. Dit is een 15 meter lange dunne buis waar met behulp van een draaggas (waterstof of helium) de cannabinoïden in gasvorm doorheen reizen. Aan het einde van de lange buis zit een FID detector (Flame Ionisation Detector).
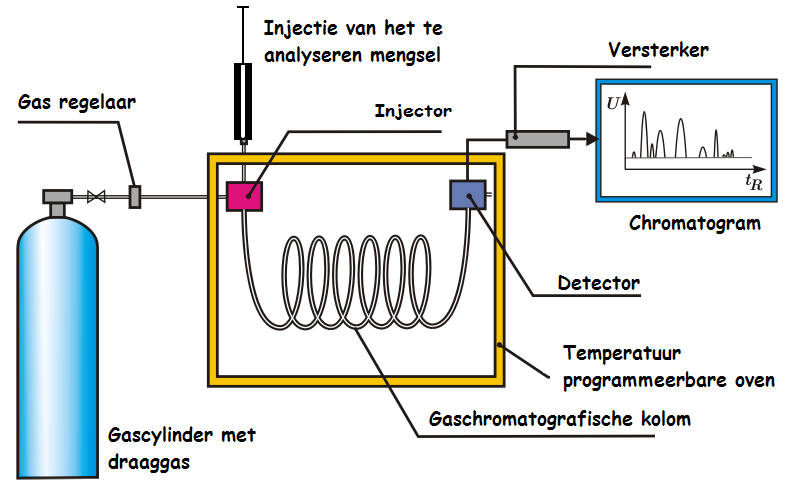
De te analyseren stoffen reizen met behulp van een draaggas door een 15 meter lange buis naar een meetpunt (FID detector).
Doordat elke cannabinoide haar eigen moleculaire gewicht heeft zal de ene cannabinoide sneller bij de detector aankomen dan de andere. De tijd die de cannabinoide er over doet om vanaf het moment van de injectie bij de detector te komen noemen we retentietijd. Aan de hand van deze tijd kunnen we de cannabinoide identificeren door deze te vergelijken met de retentietijd van de referentiestandaard.
Als alle cannabinoïden na een bepaalde tijd zijn aangekomen bij de detector dan maakt de software op de computer een chromatogram aan. Op deze chromatogram kunnen we de pieken aflezen en zo bekijken welke cannabinoïden er aanwezig zijn in het monster.
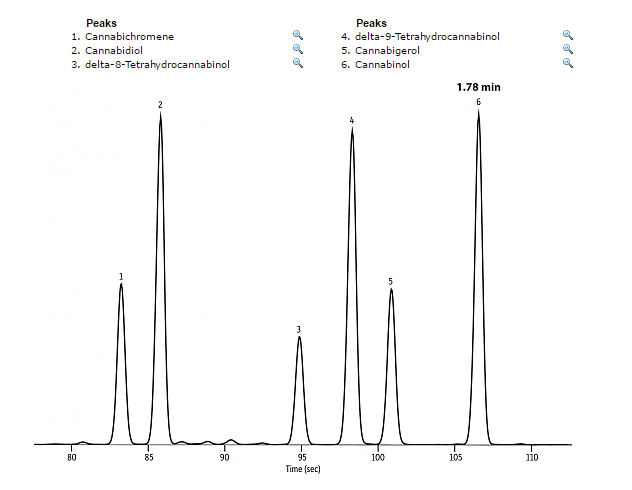
Op deze chromatogram kan afgelezen worden hoeveel cannabinoïden er in een monster aanwezig zijn.
Door de piekoppervlakte te meten kunnen we elke cannabinoïde kwantificeren en dus zeer nauwkeurig bepalen wat de concentratie is.Naast de cannabinoïden kan er met GC op dezelfde manier ook de aanwezige terpenen, pesticiden en eventuele residuen worden gemeten.
HPTLC (High Performance Thin Layer Chromatography)
Een andere standaard methode die we gebruiken is HPTLC. De HPTLC methode is goedkoper dan GC en geeft goede resultaten, maar is (achter de komma) minder accuraat dan GC. Bij HPTLC worden er 3 monsters gepipetteerd op een chromatografie plaatje. Door de capilaire werking van het plaatje worden de cannabinoïden uit elkaar getrokken waarbij – afhankelijk van de polariteit – net als bij GC, de ene cannabinoïde verder zal reizen dan de andere cannabinoide.
Aan de hand van de locatie van de spot kan de cannabinoide worden geïdentificeerd. De grootte en dichtheid van de spot kan worden gebruikt om de concentratie te bepalen via densitometry. Het bepalen van de concentratie gebeurt met speciale software welke de spot van het monster vergelijkt met de spot van de referentiestandaard.
Klinische analyse
Dankzij samenwerking met het landelijke medische laboratorium kunnen we ook cannabinoïden en haar metabolieten (tussen- en eindproducten die ontstaan na het verwerken van een stof) meten in bloed en urine. Via deze weg kunnen we bijvoorbeeld bepalen welke toedieningsvormen het beste werken en wat de biobeschikbaarheid (opneembaarheid door het lichaam) is.
Hiermee kunnen we bijvoorbeeld bepalen of een rectale toediening via een zetpil wel effectief wordt opgenomen door het lichaam en hoe bepaalde terpenen zoals myrceen de afbraak van bepaalde cannabinoïden remmen. Ook is het mogelijk om tumormarkers te meten om te zien of een behandeling met cannabisolie bij kanker wel aanslaat.
Microbiologische analyse
Bij een microbiologische analyse wordt er gekeken of er micro-organismen aanwezig zijn zoals schimmels, gisten en andere pathogene ziekteverwekkers zoals E. Coli, Salmonella en Aflatoxine B. Een monster wordt gemengd met een steriele oplossing, op een selectieve voedingsbodem geplaatst en vervolgens op de kweek gezet in een incubator. Na 24 tot 36 uur kan het kiemgetal worden bepaald om te bepalen hoeveel schimmels, gisten of andere pathogene ziekteverwekkers er in het monster aanwezig zijn.
Afwijkingen in de testresultaten
Een testuitslag geeft bij 2 verschillende testen uit dezelfde batch nooit exact hetzelfde resultaat omdat vrijwel geen enkel cannabisproduct gestandaardiseerd is. Het kan dus zijn dat de eerste test een CBD-percentage geeft van 4,51% terwijl de tweede test uit dezelfde batch een percentage geeft van 4,59%. Dit zijn de waarden die worden gemeten en die kloppen dan ook. Deze kleine ‘afwijking’ ligt niet aan de testmethode of een fout in het apparatuur, maar aan het monstermateriaal.
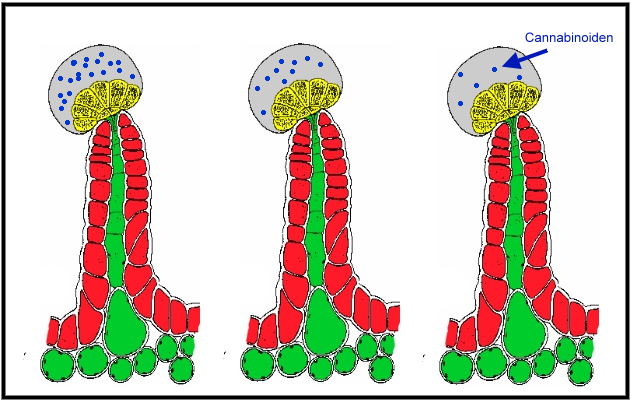
Als voorbeeld nemen we de CBD. Deze stof bevindt zich in de trichomen van de plant en elke trichoom bevat een andere cannabinoïden-samenstelling. Vooral de trichomen op de top van de plant (die meer licht ontvangen) bevatten meer cannabinoïden dan de trichomen die minder licht opvangen. Dit komt omdat de biosynthese (CBDA-S) om CBD-A aan te maken afhankelijk is van zonlicht, welke uiteindelijk middels decarboxylatie verantwoordelijk is voor de omzetting naar CBD.
De trichomen vormen bij een extract heel makkelijk kleine klontjes waarbij het ene klontje soms veel meer CBD kan bevatten dan het andere klontje. Hoe meer diversiteit aan kleine en grote klontjes er in een olie of extract zitten des te groter de afwijking tussen 2 monsters uit dezelfde batch zal zijn. Dit is eigenlijk geen afwijking te noemen want de gemeten waarden zijn zoals het daadwerkelijk is. Omdat een kleine hoeveelheid olie in de eerste stap niet te homogeniseren is zal een verdunde olie vaak ook meer diversiteit aan cannabinoïden geven waarbij elke druppel meer of minder cannabinoïden bevat en dit ook naar voren komt in de uitslag van de test.
Gestandaardiseerd product?
Bedrocan is een voorbeeld van een gestandaardiseerd product. Maar hoewel het een gestandardiseerd product is kloppen percentages op het etiket niet met de daadwerkelijke THC en CBD percentages. Wanneer we Bediol (chargenummer 15G13FB15G28-310377 ) analyseren welke volgens het etiket 6,3 % THC en 8% CBD bevat, is het potentiele testresultaat (dus na decarboxylatie) 6,2% THC en 9,6% CBD.
Bij navraag bij het Bureau voor Medicinale Cannabis blijkt het resultaat te kloppen en verklaren ze dat de daadwerkelijke waarden 30% mogen afwijken ten opzichte van de waarden die op het etiket staan vermeld. De THC- en CBD-waarden van de producten van Bedrocan kunnen dus 30% hoger of lager uitvallen dan wat er op het etiket vermeldt staat. Wat betreft de cannabinoïde-waarden is Bedrocan dus net zo ‘gestandaardiseerd’ als wanneer je zelf een wietsoort zou klonen door te stekken.
Alles samengevat komt er bij het analyseren van cannabis heel wat kijken en is het eigenlijk een wetenschap op zich. De Inspectie voor de Gezondheidszorg (IGZ) wil voor CBD-producten (CBD-olie) het maximaal toegestane THC-percentage vaststellen op 0,05 procent. Maar het is nog maar de vraag of deze richtlijn daadwerkelijk rechtmatig te controleren en te handhaven is.








































































